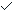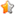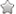布鲁菌病是由布鲁菌引起的人畜共患全身性传染病。从事畜牧养殖业人员为易患人群。近年来随着食物流动性增加,布鲁菌病从一种职业相关性疾病发展到食源性疾病,患病率有上升趋势。布鲁菌病可累及多种器官和组织,如肝脏、脾脏、淋巴结和骨髓等富含单核巨噬细胞的器官组织[1]。布鲁菌性脊柱炎(brucellar spondylitis,BS)是布鲁菌病在骨关节系统表现之一,由Kulowski和Vinke在1932年首次描述[2],其临床及影像表现与脊柱结核较为相似,极易误诊。笔者总结49例确诊的BS患者的临床及影像资料,以提高临床对该病的认识。
2012年9月至2016年10月我院确诊收治290例布鲁菌病患者,其中49例(16.9%)病变累及脊柱。本研究对此49例患者以影像资料为重点进行回顾性分析。49例中男36例、女13例,年龄23~79(54±11)岁。流行病学特点:15例(30.6%)曾有家畜饲养史或接触史,4例(8.2%)有食半熟肉类或涮牛羊肉史,挤奶工1例(2.0%),其余致病原因不明。临床症状主要有发热、多汗、乏力、腰背痛等。6例合并肝脾肿大或损伤,合并肺部感染、血小板减少、阴囊肿大各2例,1例合并布鲁菌性脑膜炎。行X线、CT、MRI检查者分别为49、28、42例,其中同时行CT、MRI检查者19例,CT增强1例、MRI增强17例。行病理检查者6例(5例手术取材,1例椎体穿刺活检);接受手术治疗者5例(3例术前误诊为'脊柱结核'),其余均行保守治疗并痊愈出院。
根据文献[3]的诊断标准,290例患者由布鲁菌病血清凝集试验(≥1∶100)阳性和(或)血及其他组织样本培养出布鲁菌确诊。49例BS患者血清凝集试验均为阳性,20例血培养布鲁菌阳性、1例椎旁脓肿穿刺液培养布鲁菌阳性。
X线采用德国Siemens Ysio数字化X线系统,自动式曝光,管电压70~85 kV,常规行正侧位摄片。CT采用美国GE Discovery 750宝石CT,扫描参数:电压120 kV,自动电流,螺距0.984,扫描层厚5.0 mm,行标准和骨重建,重建层厚和层间距均为0.625 mm;增强扫描对比剂为碘普罗胺(德国Bayer Schering Pharma AG),用量1.5 ml/kg,注射流率3.0 ml/s。MRI检查采用德国Siemens Trio Tim 3.0 T MR成像系统,体部线圈,行常规SE及FSE序列矢状面、横轴面扫描,必要时加扫冠状面。T1WI序列TR 550.0 ms、TE 9.3 ms,T2WI序列TR 4 000.0~6 000.0 ms、TE 90.0~110.0 ms,T2压脂TR 4 000.0 ms、TE 96.0 ms。矢状面:层厚4.0 mm,层间距0.4 mm,FOV 280 mm×280 mm,矩阵320×256;轴面:层厚6.0 mm,层间距2.4 mm,FOV为200 mm×200 mm,矩阵256×192。增强扫描序列为压脂T1WI,对比剂为钆喷酸葡胺(德国Bayer Schering Pharma AG),用量15 ml,注射流率2.0 ml/s。
由2名资深影像科医师共同阅片,观察评价患者病变部位、椎体受累数量、椎体破坏增生情况、椎间隙狭窄和椎体周围软组织脓肿等影像表现,其中椎周脓肿按照重点累及解剖分区椎前、椎旁、硬膜外间隙和腰大肌的不同而分别统计,意见不同时协商解决。
采用SPSS 22.0软件进行统计分析。计数资料以频数和率表示。对于样本总数≥40且所有理论频数≥5时采用χ2检验,对于样本总数<40或有理论频数<1时采用Fisher精确检验,比较同时行CT和MRI检查者的影像表现。P<0.05认为差异有统计学意义。
6例行病理检查者,显微镜下可见急慢性炎细胞浸润、肉芽组织形成、纤维素样坏死、死骨组织、局部微脓肿形成等,其中4例表现为布鲁菌肉芽肿,1例发现死骨组织。
49例BS患者中,病变累及腰椎33例(67.3%),其中L4-5 15例(30.6%)、L2-3 9例(18.4%)、L1-2及L3-4各4例(8.2%),L2-5 1例(2.0%);累及腰骶段12例(24.5%),其中L5-S1 10例(20.4%)、L2-S1与L4-S1各1例(2.0%);累及胸椎2例(4.1%),T6、T11-12各1例(2.0%);累及胸腰段T12-L1 1例(2.0%);累及颈椎C6-7 1例(2.0%)。2个椎体受累45例(91.8%),多椎体受累3例(6.1%),单个胸椎体受累1例(2.0%),病变均呈连续性分布,未见跳跃性病变。
49例患者中,14例(28.6%)表现正常、8例(16.3%)呈退行性改变;27例(55.1%)表现为受累椎体上下缘软骨终板下骨质破坏,伴或不伴增生、硬化形成骨刺或骨桥;10例(20.4%)可见明显骨刺或骨桥形成,呈鸟嘴状,向外或邻近椎体边缘伸展(
椎间隙不同程度狭窄者37例(75.5%),其中3例(6.1%)合并椎体滑脱,3例(6.1%)伴脊柱轻度后凸畸形;12例(24.5%)椎间隙正常。
行CT检查的28例中22例(78.6%)受累椎体骨质破坏,6例(21.4%)椎体变化类似于退行性改变。骨质破坏表现为多发小类圆形、囊状或斑片状低密度灶,边缘清楚或有硬化环,骨质破坏灶多位于椎体边缘,其周围骨质增生硬化,甚至形成骨桥或'花边椎'(
MPR重组图像显示椎间隙改变更清楚、直观(
9例(9/28,32.1%)椎间小关节异常,其中6例(21.4%)椎间小关节间隙狭窄,4例(14.3%)椎间小关节突增生硬化,3例(10.7%)椎间小关节内见'真空征'(
椎体周围软组织明显受累伴腰大肌脓肿形成6例(21.4%),脓肿内无钙化,CT增强示脓肿壁明显强化,脓腔不强化(
42例MRI检查患者中,31例(73.8%)椎体改变符合急性期特点,T1WI呈低信号,T2WI呈等或高信号,压脂呈明显高信号,信号均匀;11例增强扫描后椎体病变呈均匀强化。11例(26.2%)椎体改变符合亚急性期及慢性期特点,T1WI呈低信号,T2WI呈混杂高信号,压脂呈不均匀高信号,6例增强扫描病变椎体呈不均匀强化。24例(57.1%)椎体感染起始于上下终板的前缘或后缘,在椎体内以扇形蔓延。
42例中30例(71.4%)椎间隙不同程度狭窄,其中28例(66.7%)椎间盘多层结构消失,T2WI或压脂T2WI呈高信号(
13例(31.0%)椎小关节异常,其中8例(19.0%)椎小关节间隙狭窄,7例(16.7%)椎小关节增生硬化,2例(4.8%)关节腔积液呈线条样T2高信号。
42例患者椎体周围软组织可见不同程度肿胀、增厚,呈条片状或条梭形T1低信号、T2高信号,压脂呈高信号,边界模糊。信号改变主要位于病变椎体两侧、前后缘及椎管内硬膜囊前方。增强扫描17例,病灶呈不均匀条片状强化。炎症蔓延至椎体前缘35例(83.3%)、椎体后缘27例(64.3%)、椎体两侧或腰大肌周围28例(66.7%)。其中27例(64.3%)显示椎体周围软组织脓肿形成,单发脓肿11例,椎前脓肿4例、椎旁脓肿1例、硬膜外脓肿3例、腰大肌脓肿3例;多发脓肿16例(
椎体周围软组织炎症或硬膜外脓肿形成可致相应硬脊膜囊、脊髓、神经根、马尾受压或损伤,42例中17例(40.5%)硬脊膜囊受压、3例(7.1%)神经根受压伴神经刺激症状。
6例累及腰椎患者在治疗后20~50 d复查CT(2例)和MRI(4例),其中3例(1例CT、2例MRI)复查病变无明显改变。MRI复查1例脓肿范围扩大;1例T1WI、T2WI骨质破坏周围有更低信号出现,提示为骨硬化改变;1例第1次CT检查示椎体多处溶骨性骨质破坏伴死骨形成(
CT与MRI在显示椎体骨质破坏、水肿、骨质增生、椎间盘改变、脓肿形成和死骨方面,差异有统计学意义(P均<0.05)。其中脓肿数为影像显示的椎前、椎旁、硬膜外、腰大肌和竖脊肌脓肿数的总和。MRI对早期椎体骨髓水肿、椎间盘结构改变、椎体周围脓肿的显示方面明显优于CT(
BS是布鲁菌病常见且严重的并发症,在布菌病中的发生率为6.0%~53.0%[4,5,6],本研究中BS发生率为16.9%。临床表现为发热、多汗、乏力、腰背痛、神经根放射痛等。本组患者91.8%为相邻2个椎体受累,单个或多椎体受累少见,未见'跳跃'式发病,与多数文献报道一致;但也有个别文献报道多椎体受累达21.4%[7]。本组患者病变最常累及的部位为腰椎(69.4%),尤其L4和L5,与Erdem等[3]、Turunc等[8]和Gao等[9]研究相近。
X线是BS的首选影像检查方法,但容易漏诊,早期常表现正常或呈退行性改变[10],本组44.9%为此种表现。本组10例(20.4%)X线显示病变椎体骨质破坏伴明显增生硬化形成骨刺或骨桥,呈鸟嘴状,向外或邻近椎体边缘伸展,此为BS的特征性表现之一。因骨破坏的同时伴新骨形成,椎体形态多正常,或呈轻度楔形改变,这些表现与成骨细胞被激活有关[11],本组仅1例(2.0%)椎体压缩变扁、3例(6.1%)脊柱轻度后凸畸形,未发生严重塌陷的病理骨折,与Gao等[9]报道椎体塌陷及脊柱后凸发生率一致。
CT检查是对X线的重要补充,可以显示椎体终板的细微破坏、椎间盘异常、椎间隙狭窄、椎小关节改变和椎体周围软组织异常,提高病变的检出率。典型BS的CT表现为椎体终板病变持续进展造成的椎体边缘多发囊状或斑片状骨质破坏灶,很少累及椎弓根,骨质破坏的同时常伴增生、硬化,严重时有骨桥形成或形成'花边椎'。广泛的骨质破坏是BS的非典型表现,本组仅2例(7.1%)病变累及椎弓根,8例(28.6%)骨质破坏范围广,达半个椎体,但无塌陷,提示病变为进展期。值得强调的是本组6例(21.4%)有死骨形成,且1例进展期患者复查见死骨吸收,目前此类报道较少,仅见Yang等[12]报道1例,Li等[13]报道4例;多数报道均认为BS无死骨形成[3,4]。BS的这一表现需要与结核性脊柱炎鉴别。但结核性脊柱炎以骨质破坏为主,容易伴压缩性骨折和脊柱后凸畸形,脓肿常见营养不良性钙化,有助于两者的鉴别。
对本组患者影像表现分析结果显示,MRI可以先于CT早期发现骨髓水肿、椎间盘破坏和周围软组织异常,并且能极好地显示椎周脓肿的存在,增强后能更好地评估炎症累及范围、软组织受累及脓肿的情况。结合相关文献[14],我们认为MRI是早期诊断BS首选影像方法,而且DCE-MRI定量分析对BS鉴别诊断有重要价值。本组患者病变在椎体内呈扇形蔓延,这可能是BS椎体感染起始于血供丰富的终板前后缘的缘故。因为,成人椎体终板由丰富的终末小动脉吻合网供血,血流缓慢、血供丰富,易造成细菌停留,成为椎体感染最先受累的部位。而成人椎间盘为无血管化结构,早期不易受累[10]。Gao等[9]和Li等[15]的研究结果也支持我们的观点。
本组病例中27例(64.3%)显示椎体周围脓肿形成,椎旁脓肿及硬膜外脓肿一般只波及邻近椎体,范围较局限,2例腰大肌脓肿出现流注现象,增强显示脓肿壁厚且不规则强化,越来越多的研究结果也证实了BS可有脓肿形成[4];但早期文献曾报道BS无脓肿形成[7]。根据影像表现中脓肿形成和病变在椎体内呈扇形蔓延的特点,可以对BS、结核和化脓性脊柱炎进行鉴别。有文献报道,结核性脊柱炎感染病灶的发展主要为韧带下蔓延(椎体到椎体模式)[9],因此,结核性脊柱炎椎间盘早期很少受累或受累较晚。而化脓性脊柱炎由于细菌蛋白水解酶作用,椎间盘常很早且较严重受累[11,15]。虽然BS椎间盘受累也较晚,但病灶在椎体内呈扇形蔓延,由于骨质破坏的同时常伴随较明显的骨质硬化或增生,椎体很少塌陷而不同于结核。截至目前未见BS脓肿出现流注现象的报道,本组2例出现腰大肌脓肿流注现象值得关注,这点需要与结核性脊柱炎鉴别,后者脓肿一般较大,累及范围广,脓肿流注现象出现概率高,并常伴随脓肿钙化。Bozgeyik等[5]还提到结核性脊柱炎脓肿壁薄且规则强化,BS脓肿壁更倾向于厚壁且不规则强化,与本组结果一致。
综上所述,X线仍是BS筛查的首选方法,CT在显示骨质破坏方式、增生硬化程度和死骨等特点有重要的作用,有助于定位、定性和鉴别诊断。MRI敏感性高,利于早期发现病变。BS由于其非特异性的临床、影像表现及临床医生对本病普遍认识不足,极易误诊为结核性脊柱炎。当出现明显骨质破坏、死骨形成和脓肿流注现象时不应排除BS的诊断。