|
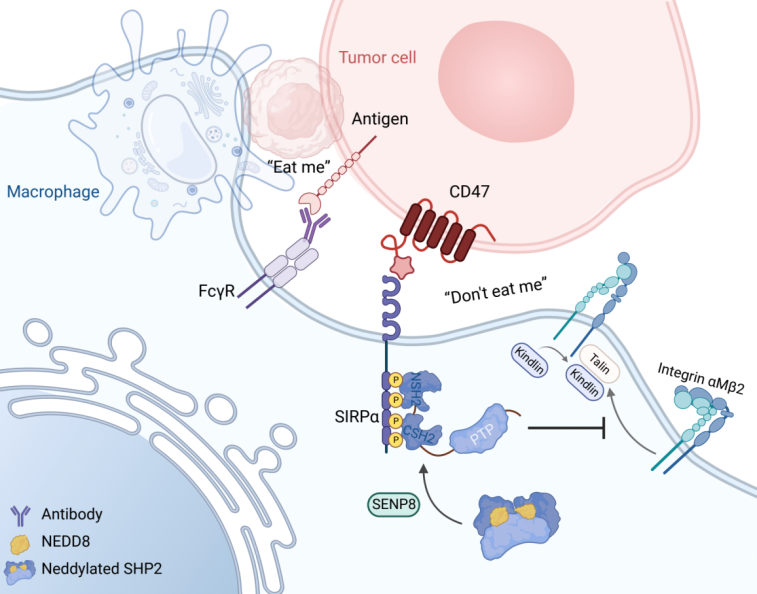
来源:生物世界 2023-01-17 10:14 作为肿瘤免疫微环境的重要塑造者,巨噬细胞通过吞噬肿瘤细胞对免疫监视做出了巨大贡献。巨噬细胞响应促吞噬信号和抗吞噬信号平衡吞噬作用,而肿瘤细胞依赖于对抗吞噬信号分子的表达与继承以逃避免疫监视。目前,通过 作为肿瘤免疫微环境的重要塑造者,巨噬细胞通过吞噬肿瘤细胞对免疫监视做出了巨大贡献。巨噬细胞响应促吞噬信号和抗吞噬信号平衡吞噬作用,而肿瘤细胞依赖于对抗吞噬信号分子的表达与继承以逃避免疫监视。目前,通过识别和靶向肿瘤中的吞噬免疫检查点来动员巨噬细胞介导的吞噬作用,已经成为开发肿瘤免疫疗法的新策略。 新近临床试验已证明联合靶向CD47/SIRPα吞噬检查点可以激活巨噬细胞的吞噬功效从而提高肿瘤治疗收益。肿瘤细胞表面高表达的配体CD47识别并结合髓系抑制性受体SIRPα,通过阻断巨噬细胞伪足形成从而解构吞噬突触。因此探究CD47/SIRPα下游调控细胞骨架重排的机制有助于更好地开发肿瘤靶向疗法。 2023年1月10日,浙江大学基础医学院、医学院附属邵逸夫医院柯越海教授课题组在 The Journal of Clinical Investigation 期刊发表了题为:SHP2 deneddylation mediates tumor immunosuppression in colon cancer via the CD47/SIRPα axis 的研究论文。 该研究揭示了一种由蛋白质翻译后修饰拟素化介导的结肠癌免疫逃逸机制,即拟素化通过影响磷酸酶SHP2的活性从而在肿瘤浸润巨噬细胞中激活CD47/SIRPα axis促进肿瘤免疫逃逸,机制上证明了蛋白质去磷酸化及其与其它修饰的互作在免疫逃逸中的重要调控作用,同时基于现有免疫疗法联合靶向抑制SHP2重塑肿瘤微环境实现了对免疫治疗耐受的结肠癌的治疗。
本研究通过临床数据的分析发现,受CD47/SIRPα信号轴调控肿瘤浸润巨噬细胞的是MSS(微卫星稳定)型结直肠癌维持免疫抑制微环境的重要因素。生信分析层面,单细胞RNA测序数据显示:相对其它类型癌症而言,结直肠癌存在特异的SIRPαhi肿瘤浸润髓系细胞,并且这些细胞具有更高的拟素化分子转录水平。 质谱流式数据显示阻断CD47/SIRPα信号轴后,结直肠癌浸润巨噬细胞群中底物拟素化修饰谱的变化依赖于去拟素化酶SENP8。MSS型结直肠癌患者的肿瘤浸润巨噬细胞显示出SENP8和免疫抑制的高相关性。
 |
|
|