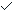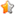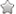习题“烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)═NO2(g)+O2(g)...”的分析与解答如下所示:
分析
(1)NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1①
NO(g)+O2(g)═NO2(g)△H=-58.2kJ.mol-1②
将方程式2②+①3NO(g)+O3(g)=3NO2(g),焓变进行相应的改变;
(2)①臭氧具有强氧化性,能氧化生成的NO2;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是其反应速率较慢;
(3)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式;
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42-=CaSO4+SO32-,溶液中c(Ca2+)==;根据CaSO3+SO42-=CaSO4+SO32-知,加入硫酸钠导致亚硫酸根离子浓度增大,浓度越大反应速率越大. 解答
解:(1)NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1 ①
NO(g)+O2(g)═NO2(g)△H=-58.2kJ.mol-1②
将方程式2②+①3NO(g)+O3(g)=3NO2(g),所以△H=2×(-58.2kJ.mol-1)+(-200.9kJ.mol-1)=-317.3kJ/mol,
故答案为:-317.3;
(2)①当n(O3):n(NO)>1时,臭氧过量,臭氧具有强氧化性,能将反应后NO2氧化为更高价氮氧化物,导致二氧化氮减少,故答案为:O3将NO2氧化为更高价态氮氧化物;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是其反应速率较慢,故答案为:可能是其反应较慢;
(3)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式为SO32-+2NO2+2OH-=SO42-+2NO2-+H2O,故答案为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42-=CaSO4+SO32-,溶液中c(Ca2+)==,所以c(SO32-)=×c(SO42-);根据CaSO3+SO42-=CaSO4+SO32-知,加入硫酸钠导致c(SO32-)增大,浓度越大反应速率越大,所以加快反应速率,提高NO2的吸收速率,
故答案为:×c(SO42-);CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率. 点评
本题为2015年江苏省高考题,考查了溶度积常数计算、反应速率影响因素、氧化还原反应离子方程式的书写、盖斯定律等知识点,综合性较强,侧重考查学生分析计算能力,知道常见物质的性质、离子方程式书写规则,难点是(4)题计算,题目难度中等.